【化学】固定模式答法合集
由于博主高考完了,本文不再更新。
必修1
化学实验
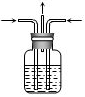 如图装置的作用是:安全瓶,防止倒吸。
如图装置的作用是:安全瓶,防止倒吸。- 选择微型实验装置的优点有:简化实验装置,节约成本;试剂用量少,能源消耗少;节省空间,缩短实验时间;减少污染等。
- 溶质A和溶质B在温度升高时呈现不同的变化趋势时,得到纯净的溶解度较低的溶质的方法是:蒸发浓缩,趁热过滤,洗涤,干燥。
- 加沉淀剂过程中,证明沉淀生成完全的操作:将溶液静置一段时间,向上层清液中继续滴加沉淀剂,没有沉淀生成,证明沉淀完全。
- 洗涤沉淀时,选用冷水/有机溶剂洗涤的原因是:降低沉淀的溶解度,减少溶解损失。
- 气密性检验答题思路:①封闭体系;②形成气压差;③得出结论。
- 溶解/浸取矿石等固体物时,将其磨碎的目的是:增大反应物的接触面积,加快反应速率,提高原料利用率/浸出率/转化率。
- 水浴加热的目的是:受热均匀,防止温度过高使产物分解。
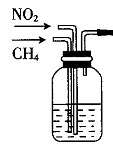 如图是利用CH4还原NO2的装置的一部分,该装置的作用是:可以通过观察气泡调节两种气体的流量;使CH4和NO2充分混合。
如图是利用CH4还原NO2的装置的一部分,该装置的作用是:可以通过观察气泡调节两种气体的流量;使CH4和NO2充分混合。- 在硬质玻璃管(气体反应装置)中填充玻璃丝的作用是:延缓气体在反应管中的停留时间。
- 蒸发结晶时,不直接蒸干溶液的理由是:减少产物中杂质的析出。
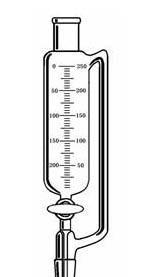 如图的这个玩意叫恒压分液漏斗或恒压滴液漏斗。
如图的这个玩意叫恒压分液漏斗或恒压滴液漏斗。- 尾气吸收装置倒扣漏斗的作用是防止倒吸。
- 一般普通托盘天平的精度为0.1g或0.2g,分析天平/电子天平为0.0001g或类似数量级的其他精度,因此当超出托盘天平的称量范围时,应当使用分析天平/电子天平。
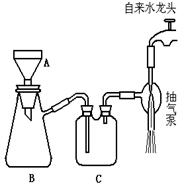 减压抽滤装置的主要仪器有:布氏漏斗、吸滤瓶、抽气泵。
减压抽滤装置的主要仪器有:布氏漏斗、吸滤瓶、抽气泵。- 滴定前润洗滴定管的操作方法是:从滴定管上口加入少量待装液,倾斜着转动滴定管,使液体润湿内壁,然后从下部方式,重复2~3次。
- 具有强氧化性的溶液(如高锰酸钾、重铬酸钾、高铁酸钾等)需要用酸式滴定管盛装,因为碱式滴定管所用的橡胶管易被氧化而老化。
- 使用分液漏斗进行萃取分液的操作为:向分液漏斗中加入溶液与萃取剂,振荡,将分液漏斗下口向上倾斜,打开活塞放出气体,静置,分液。
- 实验室中用pH试纸测定溶液pH的方法是:将pH试纸放在干燥洁净的玻璃片上,用玻璃棒蘸取溶液滴在pH试纸上,变色后与标准比色卡比较。
化学物质及变化
- 静电除尘利用了胶体的电泳性质。
- 使胶体粒子聚沉的方法:1.加热或搅拌 2.加入电解质 3.加入带相反电荷的粒子
扩展:①胶体粒子带电,但胶体呈电中性。 ②只有以上三种方法才能使胶体粒子聚沉,其他方法不是聚沉。 - 工业生产中采用对空气加压的方法提高MnO2利用率,使用碰撞理论解释其原因:加压增大了氧气浓度,使单位体积内的活化分子数增加,有效碰撞次数增多,反应速率加快,使MnO2反应更充分。
- 滴水石穿涉及的化学反应:$\mathrm{CaCO_3 + CO_2 + H_2O = Ca(HCO_3)_2 }$
金属元素
- 实验室取用金属Na的方法:用镊子取出煤油中的钠,用滤纸吸干表面的煤油,用小刀切下所需的钠,余下的放回试剂瓶中。
- 进行H2还原CuO的实验时,通入一段时间的H2后不能马上加热,应先检验氢气的纯度,因为加热不纯氢气和空气的混合物时容易引发爆炸。
- 检验Fe粉中是否含有FeO的方法:考虑到Fe直接溶解于酸时也会产生Fe2+干扰FeO的检验,我们先让固体与CuSO4溶液完全反应,然后再将过滤得到的滤渣溶解于酸检验Fe2+是否存在即可。
- CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是:CaSO3转化为CaSO4使溶液中SO32-的浓度增大,加快SO32-与NO2的反应速率。
- 久存的银制品表面会发黑,失去银白色光泽,原因是:银与空气中的氧及含硫化合物反应生成黑色硫化银,致使久存的银制品表面发黑。
- 用硫酸亚铁晶体配制FeSO4溶液时还需加入稀硫酸和铁屑。
非金属元素
- 侯氏制碱法先通入NH3,再通入CO2的原因是:NH3在水中的溶解度大,CO2在水中的溶解度较小,先通NH3可增大CO2的溶解度,产生更多HCO3–。
- 侯氏制碱法的母液(过滤走NaHCO3的滤液)中仍有大量原料,可以向母液中通入NH3,再加入细小的食盐颗粒并降温,可得到NH4Cl晶体,剩下的母液循环使用,大大提高了原料的利用率,通入氨气的目的是:氨气溶于水后产生NH4+和OH–,可增大NH4+的浓度,有利于NH4Cl析出,溶液碱性增强,NaHCO3转化为Na2CO3而不析出,可提高氯化铵的纯度。
- HCl的实验室制法:浓硫酸与NaCl晶体共热,$\mathrm{H_2SO_4(浓) + NaCl(s) \triangleq HCl \uparrow + NaHSO_4}$。
- 证明某酸是n元酸的方法:用等浓度的NaOH溶液(或其他一元强碱溶液)滴定该酸,若消耗的NaOH溶液体积是该酸溶液体积的n倍,则该酸为n元酸。
- 在有氧条件下,新型催化剂M能催化NOx与NH3反应生成N2。在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是:迅速上升段是催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢段主要是温度升高引起的NOx去除反应速率增大。
- 黑火药点燃时发生的反应为:$\mathrm{2KNO_3 + S + 3C \triangleq K_2S + N_2 \uparrow + 3CO_2 \uparrow}$,氧化剂为硝酸钾,还原剂为单质硫和碳,利用了单质S的还原性。
- 高温体系中C存在时CO2不能作为反应产物,因为会被C还原而变成CO。
- 高温体系中SiO2与CaO等碱性氧化物不能共存,因此在玻璃反应容器中不能加热进行可能生成碱性氧化物的反应,或者SiO2参与的反应产物中无碱性氧化物而是硅酸盐。
必修2
物质结构、元素周期律
- 主族元素不包括0族元素(稀有气体元素),副族元素不包括Ⅷ族元素(过渡元素包含Ⅷ族元素)。
化学反应与能量
- 验证物质在化学反应中是否为催化剂的方法:①验证是否改变反应速率;②验证反应前后质量和性质是否改变。
- 滴定管润洗后,润洗液从滴定管下口倒出。
- 中和热的测定实验中,需要多次测量温度,为避免实验误差,应当使用同一温度计,使用温度计前要先冲洗干净。
有机化合物
- 加酶洗衣粉不可以洗涤毛织品,因为酶会水解蛋白质导致衣物损坏。
- 烹鱼时加入料酒可去腥提香的原理:鱼体中的腥味物质主要是三甲胺等,能溶解在乙醇中,在加入烹饪料酒时,其腥味随着酒精挥发而被带走,料酒中含有的小分子酯本身具有香味,烹饪过程中乙醇和乙酸可能发生酯化反应生成乙酸乙酯具有香味,所以烹鱼时加入料酒可去腥提香。
- 制乙酸乙酯时加入数滴浓硫酸即能起催化作用,但实际用量多余此量,原因是:浓硫酸能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率。
- 常见有机反应整理:
- 碳碳双键、三键、醛或酚类物质可以使溴水褪色。
- 碳碳双键、三键、苯的同系物、酚类、醇及醛类可以使酸性高锰酸钾溶液褪色。
- 醛基能发生银镜反应或与新制氢氧化铜煮沸后生成砖红色沉淀。
- 含羟基、羧基可与钠反应生成氢气。
- 含酚羟基、羧基可与氢氧化钠、碳酸钠反应。
- 含羧基可与碳酸钠、碳酸氢钠反应。
- 酚羟基可与氯化铁溶液发生显色反应。
- 酯可以水解产生醇和羧酸。
- 醇或卤代烃可以发生消去反应。
- 醇、醛、羧酸可以发生两步氧化。
- 与卤素单质,在光照条件下:烷烃、不饱和烃或芳香烃中烷基上的卤代反应。
- 与液溴、铁粉:苯环上的取代(溴代)反应。
- 与浓溴水:苯酚的取代反应。
- 与氢气,在催化剂(镍)条件下:不饱和有机物的加成反应(含碳碳双键、三键、苯环、醛基、羰基的物质,羧基和酯基不能加成)。
- 在浓硫酸、加热条件下:酯化反应或苯环上硝化、磺化反应。
- 在浓硫酸、170℃条件下:醇的消去反应。
- 在浓硫酸、140℃条件下:醇生成醚的取代反应。
- 在稀硫酸、加热条件下:酯的可逆水解或二糖、多糖的水解反应。
- 与氢氧化钠溶液,在加热条件下:卤代烃或酯类的水解反应。
- 与氢氧化钠醇溶液,在加热条件下:卤代烃的消去反应。
- 与铁、盐酸:硝基还原为氨基。
- 与氧气,在铜或银、加热条件下:醇的催化氧化。
- 与银氨溶液或新制氢氧化铜:醛的氧化。
- 在水浴加热条件下:苯的硝化、银镜反应、制酚醛树脂、酯类和二糖的水解。
化学与自然资源的开发利用
- 无机非金属材料整理:
资料来源:[图文]高中化学材料专题复习 – 百度文库- 普通玻璃(钠玻璃)
成分:CaSiO3、NaSiO3、SiO2
原材料:纯碱、石灰石、石英 - 钢化玻璃
- 水泥
成分:3CaO·SiO2、2CaO·SiO2、3CaO·Al2O3
原材料:石灰石、黏土 - 陶瓷
原材料:黏土、天然矿物等
- 普通玻璃(钠玻璃)
选修3
原子结构与性质
- H的电负性达到了2.1,大于B的电负性(2.0)。
- 短周期中原子核外p轨道上电子数与s轨道上电子总数相等的元素是O、Mg。
- 碳在形成化合物时,其键型以共价键为主,原因是:C有4个价电子且半径小,难以通过得失电子达到稳定电子结构。
- 金属Fe具有导电性,温度越高其导电性越差,其原因是:温度升高,自由电子间碰撞加剧,导致自由电子的定向移动能力变弱,导电性减小。
分子结构与性质
- NH3极易溶于水的原因为:①NH3和H2O分子都是极性分子,根据相似相溶原理;②NH3和H2O分子间形成氢键;③NH3部分与水反应生成NH3·H2O。
- Cl–可以促进金属的氧化腐蚀或与酸的反应,原理是Cl–易与金属形成配合物促进反应。
- ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是:ZnF2为离子化合物,ZnCl2、ZnBr2、ZnI2的化学键以共价键为主,极性较小。
- Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是:双键中含有1个π键,三键中含有2个π键,而Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键。
- AsH3分子是三角锥形,键角为91.80°,小于氨分子的键角(107°),AsH3分子键角较小的原因是:砷原子电负性小于氮原子,其共用电子对离砷核距离较远,斥力较小,键角较小。
- CO作为配位体是以C原子作为配位原子,因为C原子半径较大,更易失去孤电子对。
- 氢化物或氢化离子写等电子体时氢原子的数量不可变化,一般改变负价原子,这是因为等电子体要求原子数必须相同。
- 在必修教材(必修2)问题中涉及共价键分类的问题,从极性与非极性角度作答;在选修教材(选修3)中从σ键或π键角度作答。
- 叠氮离子(N3–)的立体构型是直线型,中心N原子杂化类型是sp杂化,其结构如下:
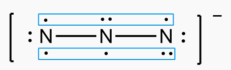
- PCl3的键角小于PCl4+键角的原因为:PCl3和PCl4+中磷原子的杂化方式均为sp3杂化,PCl3中磷原子有一对孤对电子,PCl4+中磷原子无孤对电子,孤对电子对成键电子对的斥力大于成键电子对之间的排斥力。
- H3PO3和H3PO4第一步电离程度大于第二步的原因:第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子。
- H3PO4比H3PO3酸性强的原因:H3PO3和H3PO4可表示为(HO)2PHO和(HO)3PO。H3PO3中P为+3价,而H3PO4中的点P为+5价,正电性更高,导致P—O—H中O的电子更向P偏移,越易电离出H+。
- “分子金属”是一种由铂的配合物平面分子进行层状堆砌而形成的结构,其中,铂与周围的4个硫形成了4个共价键,铂原子是否以sp3的方式杂化?简述理由:不是。若铂原子轨道为sp3杂化,则该分子结构为四面体,非平面结构。
- 测得C16S8中碳硫键的键长介于C—S和C═S键之间,其原因可能是:C16S8分子中碳硫键具有一定程度的双键性质;C16S8分子中存在离域大π键。
- NH3易与Cu2+反应,而NF3却不能,其原因是:F元素的电负性强于N元素,NF3中N—F成键电子对偏向F原子,N原子上的孤电子对难与铜离子形成配位键。
- 铵盐大多不稳定,NH4F和NH4I中,较易分解的是NH4F,原因是:F原子半径比I原子小,H—F键比H—I键强。
晶体结构与性质
- SiX4(X为卤素)的沸点依F、Cl、Br、I的次序升高的原因是:①SiX4是分子晶体,且组成结构相似;②相对分子质量依次增大,分子间范德华力增大,因此沸点升高。
- H2O的液体密度比其固态的大,原因是:水结冰由于氢键的方向性,使分子排列更加有序,分子间隙增大,故水的密度比冰大。
- 判断晶体和非晶体最可靠的方法是:X射线衍射实验。
- 在晶胞中见到了C60时,写分子式需要将其视作一个整体,C的个数需为60的整数倍以表达C60是一个整体。
- 随着阳离子半径的增大,碳酸盐的分解温度逐步升高,原因是:碳酸盐分解过程实际是晶体中阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,金属氧化物的晶格能越大,对应的碳酸盐就越容易分解。
- 金刚石和石墨的物理性质差异很大,其中熔点较高的是石墨,从结构分析:石墨为混合型晶体,金刚石为原子晶体,二者熔点均取决于碳碳共价键,前者键长短,则熔点高;硬度大的是金刚石,其结构原因是:石墨硬度取决于分子间作用力,而金刚石取决于碳碳共价键。
选修4
化学反应与能量
化学反应速率和化学平衡
- 绝热恒容容器中压强不再变化可以证明反应已达到平衡,因为化学反应总伴随着热效应,使得容器体系温度改变,导致气体压强改变。
- 两个反应在相同情况下反应速率有差别,可供考虑的角度有:反应物浓度不同、反应物溶解度不同(在溶液中发生的反应)、活化能不同等。
- 常见的能提高反应速率的方法有:提高反应物浓度(增加反应物的量或压缩体积)、提高温度、改进催化剂等。
水溶液中的离子平衡
- 电解池阴极反应为2H++2e–=H2↑,Fe3+可在阴极区沉淀完全,从其对水的电离平衡影响角度解释其原因:水中的H+在阴极区放电,H+浓度减小促使水的电离平衡H2O$\rightleftharpoons$H++OH–正向移动,阴极区OH–浓度增大与Fe3+结合而沉淀完全。
- 不氧化Fe2+而使Zn2+沉淀的后果是Zn2+和Fe2+分离不开,原因是:Zn2+和Fe2+的Ksp相近。(注:$K_{\mathrm{sp}}\mathrm{[Zn(OH)_2]} = 10^{-17}$,$K_{\mathrm{sp}}\mathrm{[Fe(OH)_2]} = 10^{-17}$)
电化学基础
- 钛的冶炼新法是剑桥电解法。以含少量CaCl2的CaO熔融物作为介质,电解时在阴极生成的Ca进一步还原TiO2得钛。利用中学所学知识可以预测CaCl2的作用包含:增强导电性、降低CaO的熔点。
- 电解时电压过高会导致阴极还原产物产率降低,可能的原因是:H+参与了电极反应。(阳极产物也可用类似的思路解答)
- 离子交换膜的作用有:①能得到纯度更高的电解产物;②避免不同电极上生成的气体相互反应。

ks哥哥太巨啦